アトラス日本合同会社のプレスリリース
このレポートでは、私たちの腸内細菌は常に免疫系と相互作用し、がんを含む様々な疾患のリスクに影響をおよぼしていることや、腸内細菌ががんの予防や治療に果たす役割、そして腸内細菌ががん細胞と戦うために免疫系をどのように活性化させるかについて説明しています。
人間は、銀河系の星の数よりも多く、猫の脳と同じ重さの何兆もの微生物を受け入れています。我々は3,000万個のヒト細胞の他に、39兆個の細菌が存在し、平均して1,000以上の異なる種から構成されています。そして最も重要で大きな微生物群は大腸に存在し、「腸内フローラ」と総称されます。この微生物の中に存在する遺伝子の合計は約33億個で、人間の遺伝子の合計、約23000個を凌駕しています。
この10年の進歩により、科学者たちは腸内フローラとその機能の分析を行うことが可能となり、ヒトゲノム・プロジェクトに匹敵する健康研究の新たな分野を築きつつあります。現在では、私たちの常在菌は、腸内の免疫細胞と双方向のコミュニケーションをとっており、研究者はこれを「腸内フローラ免疫軸」と呼んでいます。さらに最近では、がん研究においても腸内フローラが注目されるようになり、微生物が腫瘍の発生やがん治療の効果に影響を与えることがわかってきました。
腸内フローラ ⇄ 免疫軸:
免疫系の70%は腸のパイエル板と呼ばれるドーム状の構造物に存在します。腸に免疫細胞が密集しているのには、それなりの理由があります。これらの免疫細胞は、監視塔の番人のように腸に有害な病原体が通行していないかどうかを調べ、病原体に反応して炎症を引き起こします。
免疫細胞は常に完全に機能しているわけではなく、有害な病原体と良性の細菌を区別することを学習していきます。腸内細菌はこの重要な免疫教育を行っており、免疫細胞が善玉と悪玉、無害なものを区別できるように訓練しているのです。<https://www.cancer.gov/research/areas/public-health/immune-system-microbiome>
腸内フローラを持たずに育てたマウスは、免疫細胞が微生物訓練をしていないため免疫系が未熟で、抗炎症性制御T細胞(Treg)がありません。さらに、無菌マウスは微生物が腸壁に付着するのを阻止する免疫細胞であるIgA抗体の産生が変化していることがわかっています。<https://www.frontiersin.org/articles/10.3389/fimmu.2021.622064/full>
一方、無菌マウスを腸内フローラが存在するネズミと一緒に飼育すると、微生物のコロニー形成と並行して、免疫系が予想通りに発達し始めることが分かりました。<https://www.icr.ac.uk/blogs/the-bigger-picture/page-details/inside-story-the-microbiome-and-cancer>
帝王切開で生まれた子どもは、アレルギー、自己免疫、いくつかの炎症性疾患の発症率が高く、粉ミルクで育った子どもにも同様の関連性が認められました。研究者らは、これらの変数が幼少期の多様性を低下させ、腸の免疫訓練を妨げ、免疫機能不全のリスクを高めていると推論しています。
腸内フローラ、炎症、がんの発生の関連性:
腸内フローラが1~5歳頃からの乳児の免疫系の発達に重要な役割を果たすことは分かっていますが、微生物は幼少期以降も免疫細胞と関わりを持ち続けています。
健康な腸内フローラとはどのようなものかを定義することはまだ困難ですが、多様性の欠如と病原性の高い種の増加は、腸内外の炎症の引き金となります。炎症性腸内フローラは、潰瘍性大腸炎やクローン病といった疾患のリスクを高める可能性があり、これらはいずれも大腸がんのリスク上昇と関連しています。
微生物は、免疫細胞に直接ドッキングするか、代謝産物を介して間接的に影響を与えることができます。例えば、がんとの因果関係が指摘されている唯一の細菌であるピロリ菌という病原性微生物は、腫瘍の成長を促進し、身体の免疫反応を低下させることができます。まず、ピロリ菌はCagAと呼ばれる炎症性サイトカインを宿主細胞に注入することができ、このCagAは細胞内に侵入すると、DNAを損傷し発がん性を発揮します。さらに、ピロリ菌は炎症性シグナル分子が滝のように流れる状態を引き起こし、周囲の組織を腫瘍の増殖がしやすい状態にします。
がん研究で注目されている微生物のひとつに、大腸がんと強く関連するフソバクテリウム・ヌクレアタムという細菌種があります。 <https://genome.cshlp.org/content/22/2/292.short>
大腸がんとの因果関係は明らかにされていませんが、フソバクテリウム・ヌクレアタムは複数の炎症性代謝産物を産生することが知られており、これら全てが腫瘍の増殖に好都合な環境を作り出しています。
<https://www.sciencedirect.com/science/article/pii/S1936523319300233>
この菌は免疫監視機構を弱め、キラーT細胞を停止させることでがん細胞の成長と増殖の抑制を妨げます。
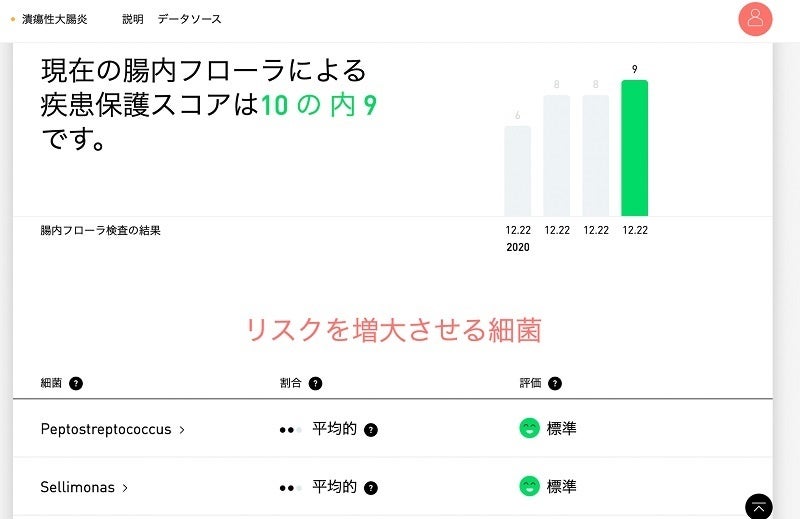
- アトラス腸内フローラ検査<https://atlasbiomed.co.jp/microbiome>を使うと、潰瘍性大腸炎とクローン病のリスクスコアを知ることができます。さらに、自分固有の腸内フローラが持つ炎症誘発の可能性を知ることができます。
腸内細菌は免疫療法の鍵なのか?:
免疫療法は、患者さんの免疫システムを利用してがん細胞と戦う生物学的療法の一種です。T細胞移植療法(TCTT)や免疫チェックポイント阻害剤(ICI)など、さまざまな種類があります。ICIは、がん腫瘍が体の免疫反応を弱めるために標的とするキラーT細胞の切れ目を無効にします。そうすることで、がん細胞に対する免疫反応を高め、抗腫瘍効果を高めることができるのです。ICIは進行したがんも縮小させることができますが、多くの人が効果を得ることができません。例えば、メラノーマの患者さんの50%は、治療に対する反応が悪いのです。
2018年、権威ある学術誌「Science」が3本の論文を発表し、腫瘍学コミュニティで大きな反響を呼びました。これらの研究は、腸内フローラの構成と免疫チェックポイント阻害剤のがん治療効果との間に強い関連性を見いだしました。<https://www.cancer.gov/news-events/cancer-currents-blog/2018/gut-bacteria-checkpoint-inhibitors>3つの研究のうち、2つはメラノーマ患者の腸内フローラ構成を、1つは上皮性腫瘍の患者の腸内フローラ構成を調べたものです。
研究チームは、被験者がPD-1/PD-L1(免疫チェックポイント阻害薬)ならびにそれらの阻害薬をつかったICI治療を受ける前に糞便サンプルを採取し、薬剤に対する反応を測定しました。
3つの研究すべてにおいて、腸内フローラ組成と薬剤反応との間に強い関連性があることが判明しました。さらに、治療に成功した被験者はある種の微生物種をより多く保有していました。
メラノーマ患者を対象とした最初の研究では、治療に反応した患者は、反応しなかった患者よりも多様性が高く、ルミノコッカス科の細菌に富む腸内フローラを持っていることがわかりました。https://www.ncbi.nlm.nih.gov/pubmed/29097493
3つ目の研究 https://www.ncbi.nlm.nih.gov/pubmed/29097494 では、腸内フローラの構成と免疫療法への反応に強い関連があることがわかりました。特に、ビフィドバクテリウム・ロンガム、コリンセラ・アエロファシエンス、エンテロコッカス・フェシウムは、免疫療法に反応した患者の腸内フローラに多く含まれていることがわかりました。研究チームは、反応した患者の糞便サンプルを無菌マウスに移植しました。一般に、無菌環境で飼育されたマウスは、免疫系が未発達なため、免疫療法への反応が低いことがわかっています。移植後、マウスは腫瘍の制御が改善され、治療への反応がより効果的になったことから、糞便移植はがん患者を免疫チェックポイント阻害剤(免疫ががん細胞を攻撃する力を保つ薬)に誘導し、その効果を高めることが明らかになりました。
3つ目の研究では、PD-1治療を受ける前の進行した腎臓がん、膀胱がん、肺がんの患者の腸内フローラ組成を調べました。先行研究と同様に、腸内微生物のコミュニティとがん治療におけるPD-1薬の効果との間に強い相関があることがわかりました。D-1治療後1-2カ月以内に抗生物質治療を受けた人は、免疫療法への反応性が低く、全体の生存率も低かったのです。
がん患者は治療に先立って頻繁に大量の抗生物質を服用することが多く、この研究は、腸内フローラを介して免疫系を弱体化させる可能性を示唆しています。
研究チームは、反応者と非反応者の腸内細菌組成を比較した結果、免疫療法への反応性とアッカーマンシア ムシニフィラの相対的存在量に有意な関連があることを確認しました。さらに、ヒトの免疫療法反応者の微生物を腸内フローラを持たないマウスに移植すると、主に炎症性サイトカインであるインターロイキン12に作用して、PD-1治療の効果が高まりました。さらに最近の研究では、がん治療反応における腸内フローラの役割をさらに裏付けるものとなっています。
今年初めに発表された研究論文は、腸内フローラが免疫療法の効果に影響を与えるかどうか、また、もしあるとすれば、どの細菌種が治療成績の改善に関連するかを明らかにすることを目的にしています。<https://www.kcl.ac.uk/news/healthy-gut-microbiome-improves-success-of-cancer-treatment>この研究ではでは、複数の研究から集められた147人のメラノーマ患者の腸内フローラを分析しました。腸内フローラの構成と免疫療法の奏効率との間に関連性があり、奏効者は以下の細菌種が多く存在することが報告されています。
- ビフィドバクテリウム・シュードカテヌラータム
- Roseburiaspp (酪酸産生菌)
- アッカーマンシア ムシニフィラ
マウスの研究では、微生物の代謝物であるイノシンが、免疫チェックポイント療法に対する反応を改善することが観察されています。ビフィドバクテリウム・ロンガム(ビフィズス菌)がこの化合物を産生することが分かっており、前述のいくつかの研究のうちの1つで、免疫療法の反応性の改善と関連していました。一貫したバイオマーカーはなく、腸内フローラとがんとの関連は、単一の発がん性種を特定するよりも複雑であることがわかります。 <https://www.sciencedirect.com/science/article/pii/S1535610820304797>
腸内フローラを標的にしたがん治療の将来性:
遺伝子とは異なり、腸内フローラは食事や生活習慣、プロバイオティクスの補充、糞便移植によって変化させることができます。理論的には、研究者はこれらの腸内フローラを標的とした治療法を用いて、免疫療法に適した「がん腸内フローラ」を作り上げることができます。
微生腫瘍学研究は始まったばかりですが、微生物の操作によってがん治療の効果が向上するかどうかを確認するために数多くの研究が行われています。しかし、微生物とがんの関係、「がん腸内フローラ」とはどのようなものなのか、また、免疫療法の効果を高めるにはどのような腸内フローラ構成が最適なのかは、まだ明確なことはわかっていません。また、「がん腸内フローラ」は1種類ではなく、がんのリスクを高める可能性のある微生物の組み合わせが複数存在するとも考えられています。
がんのリスクを低下させるために実行すべきこと:
現在わかっていることは、酪酸産生菌が豊富で多様でバランスのとれた腸内フローラが、大腸がんの危険因子である潰瘍性大腸炎やクローン病などの炎症性疾患のリスクを低減する可能性があるということです。
免疫力が低下している場合、生きた微生物を含むプロバイオティクス食品は、感染のリスクをもたらす可能性があります。プロバイオティクス食品とプレバイオティクス野菜を豊富に含む食事は、有益な細菌を促し、腸内フローラの多様性を高め、免疫の健康をサポートする可能性があります。繊維質の多い果物、色とりどりの野菜、豆類、健康的な脂肪、全粒穀物、種子類を豊富に含む地中海ダイエットを実践することをお勧めします。
地中海食は、大腸がんや全死亡のリスク低減につながることが、臨床試験で確認されています。<https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5723389/> さらに、赤肉や加工肉の摂取を控えるほど、腸がんのリスクが低下することが研究で証明されています。<https://www.who.int/news-room/questions-and-answers/item/cancer-carcinogenicity-of-the-consumption-of-red-meat-and-processed-meat>
まとめ
- 大腸には、腸内フローラとして総称される何兆もの微生物が生息しています。私たちの免疫システムの70%は腸に集まっていて、無害な微生物の生息と病原性微生物の排除を常に行っています。
- 腸内細菌は、免疫系の発達を促し、免疫のホメオスタシス(生体恒常性)を制御し、炎症を促進または抑制します。
- 腸内フローラの状態が健全でない場合、悪性度の低い慢性炎症を促進し、がん腫瘍の成長を促す可能性があります。さらに、少なくとも1つの細菌、ピロリ菌ががんの原因物質であることが知られています。
- 免疫療法は、がん細胞と闘うために人の免疫システムを利用するものです。免疫チェックポイント阻害剤は、一般的な免疫療法の一種で、キラーT細胞の切断を阻害し、体の免疫反応を高めます。免疫チェックポイント阻害剤は腫瘍と闘う上で非常に有効ですが、メラノーマ患者の50%が治療に対して反応が悪いか、全く反応しないことがあります。
- 動物およびヒトでの研究から、人の腸内フローラの多様性と構成が、免疫療法、特に免疫チェックポイント阻害剤に対する反応性に影響を与えることが示唆されています。
- 食事療法、プロバイオティクス、精密抗生物質、糞便に含まれる腸内細菌を移植するなどの方法で腸内細菌を操作することにより、免疫療法の奏効率を高めることが期待されています。
免責事項:この記事は情報提供のみを目的としたものです。専門的な医学的アドバイス、診断、治療の代わりとなるものではありません。
「Atlas遺伝子検査」
ユーザーの唾液サンプルから遺伝⼦データを解析・解釈・可視化します。予防・改善可能な疾患発症リスクにフォーカスした検査です。この検査によって2型糖尿病、クローン病、パーキンソン病などの13の多因⼦疾患発症リスクを評価するとともに個⼈特性・形質を判定します。科学的根拠に基づいたパーソナライズされた健康増進アドバイスを提供します。
「Atlas腸内フローラ検査」
ユーザーの糞便サンプルから微⽣物遺伝子を解析、解釈、可視化します。この検査でユーザーの腸内フローラの酪酸・ビタミン合成能⼒、⾷物繊維の分解能⼒、腸内フローラの多様性、プロバイオティクスと善⽟菌の状態を評価します。さらに2型糖尿病、クローン病などの5の疾患の発症リスクから腸内フローラがどの程度保護してくれているかを評価します。さらに腸内フローラのタイプを判定し、検査結果を基に、パーソナライズされた⾷事に関するアドバイスを提供します。
ユーザーの唾液、糞便サンプルはAtlas Japanに送られ、分析されます。Atlas検査を受けたユーザーは、Atlas Japanがオンラインで提供するパーソナルアカウントにアクセスし、検査結果、健康状態の改善に結びつくことが科学的に証明されているパーソナライズされたアドバイスやお勧めの食品を確認することができます。
Atlas Biomedについて
Atlas Biomedは、2016年にイギリスで設立されたパーソナライズドヘルス企業です。遺伝子および腸内フローラ領域の最先端技術と、ユーザーの遺伝子、腸内フローラ、ライフスタイルデータを組み合わせることで、健康状態を多面的に把握します。それらをもとにパーソナライズされたアドバイスを提供し、健康に関する意識向上及びデータに基づいた意思決定を支援します。AtlasBiomedの検査キットは、英国、欧州16か国そして日本で提供しています。アトラス合同会社はAtlasBiomedの日本の子会社です。
Atlas Japanは、日本のユーザーに遺伝子や腸内フローラに関連する最新の情報やアトラスバイオメッドの研究者による考察を掲載する、ブログページhttps://atlasbiomed.co.jp/blog/ を開設しました。メーリングリストに登録し、ブログを購読すると、最新の情報や10%オフのプロモードのプレゼントなどキャンペーン情報が届きます。